抗体薬物複合体(ADC:Antibody-Drug Conjugate)は、がん細胞に対して選択的に強力な細胞毒を届ける革新的な治療技術です。
第4回では、ADCが細胞内に取り込まれた後、いかにしてリンク技術によってペイロードが放出され、がん細胞を死滅させるかという最終ステップに焦点を当てて解説します。ADCの治療効果は、ターゲット認識と同様に、薬物の放出とその後の細胞内作用にも強く依存しています。
1. ADCの細胞内取り込み:エンドサイトーシスによる内部化
ADCが細胞表面の抗原と結合すると、細胞膜はADC-抗原複合体をエンドサイトーシス(endocytosis)によって取り込み、エンドソームと呼ばれる小胞へと運びます。
その後、エンドソームはリソソーム(lysosome)と融合し、酸性環境・酵素によって内容物が分解され始めます。ここで、リンクのタイプによって異なるメカニズムでペイロードが放出されます。
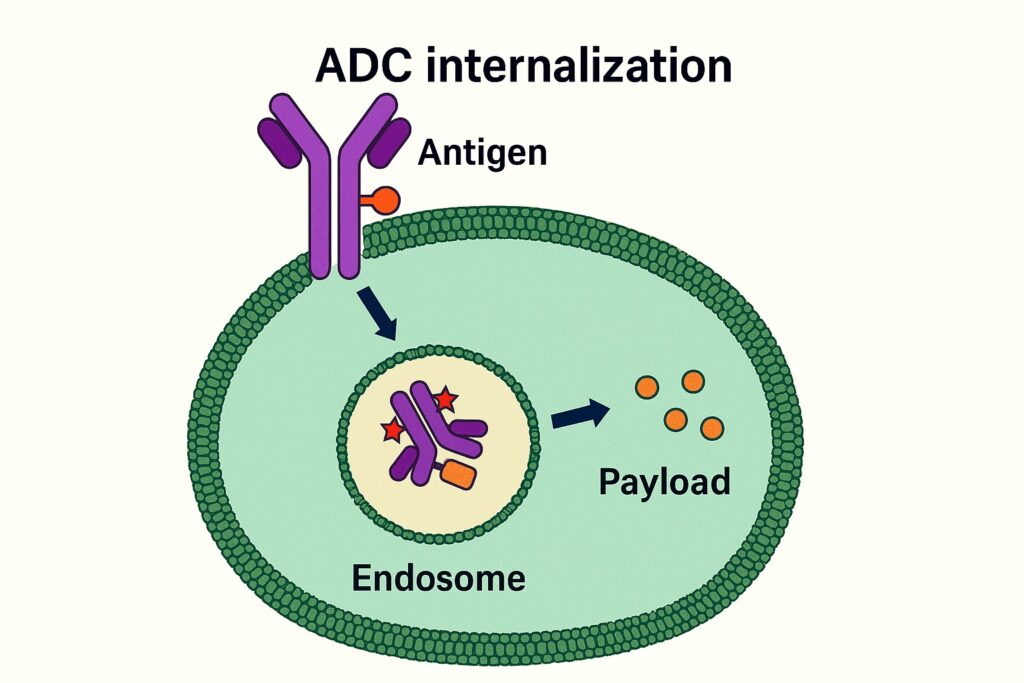
2. リンクの切断とペイロードの放出
- 酸性切断型リンク(acid-cleavable linker):リソソーム内のpH(約5.0)で加水分解され、ペイロードが放出されます。
- 酵素切断型リンク(protease-cleavable linker):リソソーム酵素(カテプシンBなど)によって切断されます。
- 自己分解型リンク(self-immolative linker):酵素や条件に反応して自己崩壊し、薬物を遊離します。
これらのリンク設計により、「がん細胞内のみでペイロードが活性化される」ように制御されている点がADC技術の肝です。
3. 細胞内でのペイロードの作用メカニズム
放出されたペイロードは細胞内で以下のように作用します:
- 微小管阻害剤(MMAEやDM1など):細胞分裂のための微小管を阻害し、細胞周期を停止させアポトーシス(細胞死)を誘導。
- DNA損傷誘導型(Calicheamicinなど):DNAを直接切断して、強制的に細胞死へと誘導。
これらは通常の化学療法薬よりも遥かに強力で、正常細胞に投与すれば致死的です。ADCのターゲット精度と薬物放出制御が極めて重要である理由はここにあります。
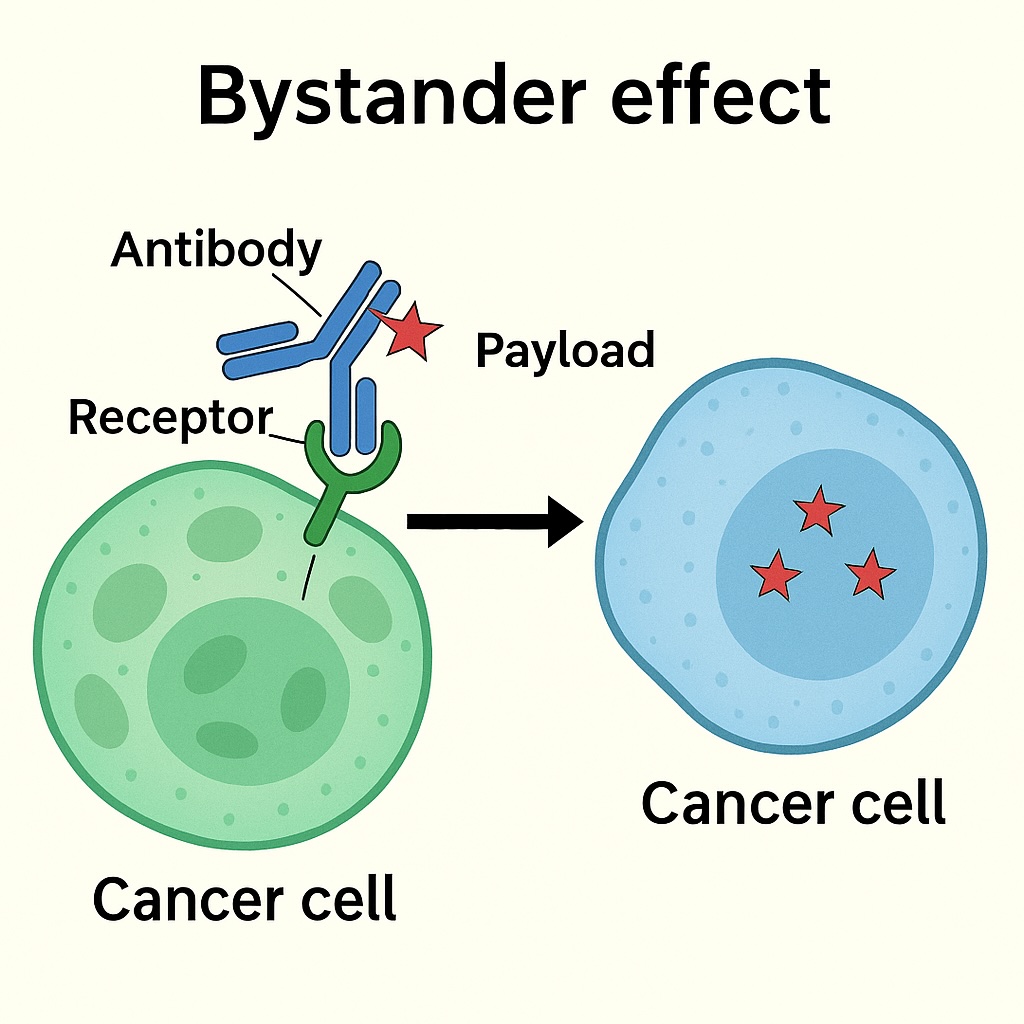
4. バイスタンダー効果とその利点・課題
一部のペイロードは細胞膜を通過する性質を持ち、放出後に周囲のがん細胞にも拡散して効果を及ぼします。これがバイスタンダー効果です。
特に、抗原発現が不均一な腫瘍に対して効果的ですが、正常組織への毒性リスクも増加するため、リンクとペイロードの選定が重要です。
5. 治療成績と副作用の最適化へ向けて
現在のADC研究では、以下のような改良が進んでいます:
- リンカー安定性:血中での耐久性を高めつつ、リソソーム内でのみ反応させる。
- ペイロードの多様化:新規の細胞死経路をターゲットにする薬物の導入。
- 抗原選定とバイスタンダー効果の最適バランス:効果と安全性の両立。
まとめと次回予告
本記事ではADCの最終ステップである細胞内作用機構を丁寧に解説しました。抗体・リンク・ペイロードが三位一体で機能することによって、がん細胞に選択的に致命的な打撃を与える仕組みが明らかになってきました。
次回はおまけ回として、現在のADC開発企業とバイオテックの最新競争状況を紹介します。














コメント