若返り・老化・再生研究シリーズ:第4回 幹細胞老化の5つの特徴と再生医療への示唆
はじめに
加齢とともに私たちの体内で起こる最も根本的な変化の一つが「幹細胞老化」です。幹細胞は、組織の恒常性維持や再生の基盤となる存在であり、その機能が損なわれることは臓器レベルでの老化や疾患の進行に直結します。今回の第4回では、2024年に『Cell Stem Cell』誌に掲載されたレビュー論文「Hallmarks of Stem Cell Aging」に基づき、幹細胞老化を特徴づける5つの主要な変化と、それが再生医療や若返り戦略に与える示唆を解説します。
幹細胞老化の9つの特徴
- DNA損傷とゲノム不安定性:幹細胞でもDNA損傷の蓄積により、自己複製能と分化能力が低下。
- エピジェネティックな変化:DNAメチル化やヒストン修飾などの変化が加齢とともに進行。
- 代謝の変容:ミトコンドリア機能の変化やエネルギー代謝の再編が幹細胞の運命に影響。
- タンパク質恒常性の破綻:プロテオスタシスの破綻により、異常タンパク質の蓄積が起こる。
- クロマチン構造の変化:加齢によってクロマチン状態が緩み、転写制御が乱れる。
- 細胞間コミュニケーションの変化:ニッチ環境の変化により、幹細胞活性が低下。
- 炎症の増大:慢性的な炎症が幹細胞機能を抑制。
- 老化細胞の蓄積:老化細胞が微小環境に悪影響を及ぼす。
- 幹細胞数と機能の低下:自己複製と多分化能の喪失。
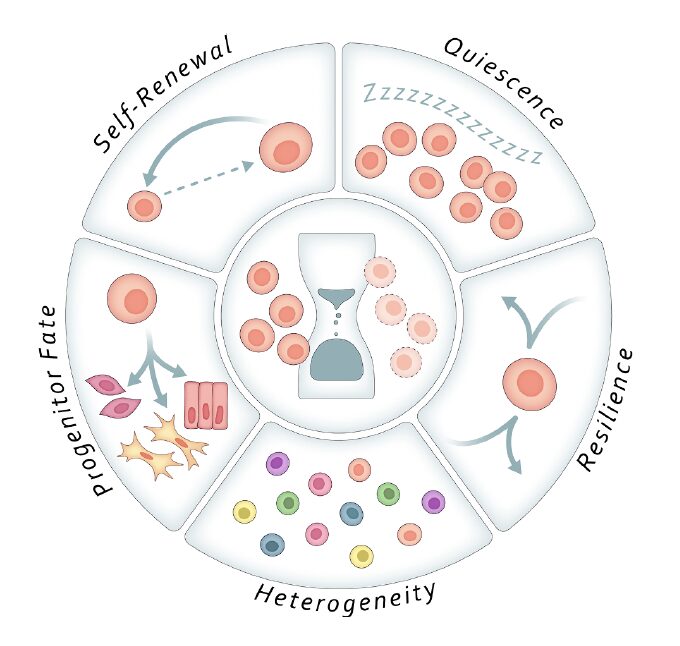
1. 幹細胞の休止状態(Quiescence)の深まり
加齢により、幹細胞はより「深い休止状態(deep quiescence)」へと移行する傾向が観察されています。この状態では、幹細胞は外部刺激に対して応答しにくくなり、再活性化されるまでの時間が長くなる、あるいはそもそも活性化されなくなる可能性があります。これは損傷時の組織修復遅延や再生力の低下を招く要因です。
2. 自己複製性の低下と分化バランスの破綻
老化した幹細胞は、自己複製能を失うだけでなく、特定の分化系列への偏り(例:造血幹細胞ではミエロイド偏向)を示すことがあります。これは、幹細胞ニッチやエピジェネティック環境の変化、転写因子のバランス異常によって引き起こされるとされます。
3. ストレス耐性とレジリエンスの低下
若年の幹細胞は、DNA損傷や代謝ストレスに対して高い回復力を示しますが、加齢によりその能力が大きく損なわれます。オートファジー機能の低下、ミトコンドリア異常、ROSの蓄積といった現象が観察され、幹細胞の寿命と機能に影響します。
4. 集団としての異質性(heterogeneity)の変化
幹細胞集団は本来、機能的・遺伝的に多様性を持つことが健全性の指標とされます。しかし加齢に伴い、特定の細胞クローンが優占するようになり、全体の機能的多様性が低下する傾向が報告されています。これはクローン性疾患や悪性化リスクとも関係します。
5. 分子経路の攪乱と可塑性の喪失
老化幹細胞では、Notch, Wnt, TGF-β などの主要なシグナル伝達経路が攪乱され、可塑性(プラスチック性)が失われます。これにより環境変化や損傷に応じた柔軟な応答ができなくなり、慢性炎症や線維化を促進する要因となります。
老化幹細胞に対する介入戦略
これらの特徴に対して、研究者たちは以下のような介入戦略を模索しています:
- ナディアンス状態の解除:休止状態の解除や再活性化誘導
- エピジェネティック修復:クロマチンリモデリングやリプログラミング
- 代謝補正:ミトコンドリア機能の再構築、オートファジー促進
- 免疫・炎症制御:加齢に伴う慢性炎症(inflammaging)の抑制
私のひとこと(所感)
老化幹細胞の研究は、もはや加齢の結果を分析するだけの領域ではなく、「再生力をどう維持・回復するか」という実用的視点へと進化しつつあります。特に、単一の因子ではなく、可塑性・代謝・環境応答といった“複合ネットワーク”として幹細胞老化を捉える視点は、若返り技術の開発にも直結します。幹細胞の“質”を維持する技術こそ、今後の再生医療や健康長寿社会に向けた重要な鍵となるでしょう。
出典:Hallmarks of stem cell aging, 2025 July 03, Cell Stem Cell, Cell Press





コメント