オルガノイドモデルにより治療可能性が示唆された小児神経疾患
2025年6月、米セント・ジュード小児研究病院のHeather Mefford医師らは、極めて稀な小児てんかん疾患「UBA5関連脳症」に対して、ヒト脳オルガノイドモデルを活用した研究により、新たな治療的アプローチの可能性を提示しました。この研究は、Science Translational Medicine誌に掲載され、患者由来の細胞を用いて、疾患の発症メカニズムから治療まで一貫して解析した点で大きな注目を集めています。
UBA5変異とてんかんの関係性:タンパク修飾異常がもたらす神経機能障害
UBA5はufmylationと呼ばれるユビキチン様修飾に関与する酵素であり、神経系の恒常性維持に重要な役割を担っています。対象となった患者では、UBA5遺伝子に「機能喪失型アレル」と「部分活性保持型アレル」が一方ずつ存在し、結果的にUBA5の総活性が大きく低下。このことが神経細胞の発達やネットワーク形成に悪影響を与え、発作や認知機能障害を伴う脳症を引き起こしていました。特に、ufmylation低下により抑制性シグナルが脆弱化する点が、発症の根幹であると考えられます。
患者由来オルガノイドの応用:臨床と基礎の橋渡し
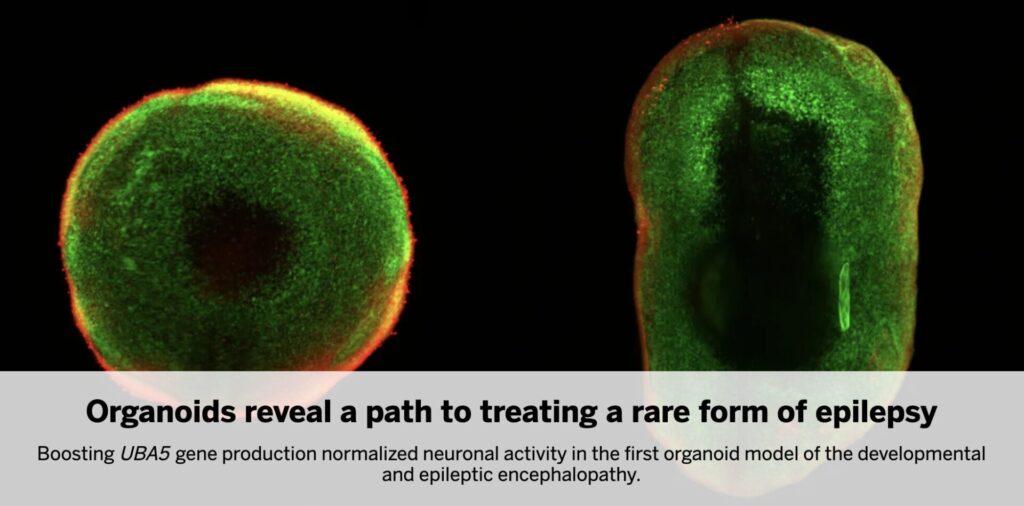
研究チームは、患者およびその両親のiPS細胞から脳オルガノイドを作成し、発達経過と神経細胞構成の比較を行いました。患者オルガノイドは明らかにサイズが小さく、内部構造の発達も遅延していました。中でも注目されたのは、抑制性ニューロン(GABA作動性)の顕著な減少と、それに伴う神経発火パターンの乱れでした。これにより、UBA5変異がどのように脳機能を変容させているかが、臨床症状と直接結びつけて可視化されたのです。動物モデルを使用せず、完全にヒト由来の細胞で再現された点は、治療戦略のトランスレーショナルな価値を高めています。
治療的アプローチの評価:UBA5発現増強による機能回復
オルガノイドモデルを用いて、研究チームは2つの方法でUBA5の発現を増加させる介入実験を行いました。ひとつはCRISPRa(CRISPR活性化系)によりUBA5プロモーターを刺激する方法、もうひとつはSINEUPという長鎖非コードRNAを利用し翻訳効率を高める方法です。いずれの方法でもufmylationレベルが回復し、神経細胞の発火異常が改善されました。特にSINEUPは一過性の効果であったものの、UBA5の発現量を適切に制御することが治療の糸口になりうるという強いエビデンスを提供しました。
今後の展望と課題:翻訳研究から臨床応用へ
この研究はproof-of-concept段階ではあるものの、今後は以下のような課題と可能性が広がっています:
- 抑制性ニューロンがUBA5変異に対して特異的に感受性が高い理由の分子メカニズム解明
- SINEUPやCRISPRaの長期効果の評価およびin vivoへの応用性
- 遺伝子治療型介入を胎児期・新生児期に導入するための倫理的・技術的基盤整備
- 薬剤送達システム(ベクター、ナノ粒子等)の安全性と持続性の向上
ひとこと
この研究は、ヒトオルガノイドのみで希少神経疾患の発症機構と治療可能性を描き出した点で、動物実験に依存しない創薬研究の新たな到達点を示しました。小児希少疾患領域における研究の加速には、このような「患者由来モデル」に基づく研究が今後ますます重要となっていくでしょう。


コメント