はじめに
脳や網膜を守る血液–脳関門(BBB)および血液–網膜関門(BRB)は、神経系の恒常性を保つために欠かせない重要な構造です。これらの関門は、外部からの有害物質や免疫細胞の侵入を制限しつつ、必要な栄養やホルモンを選択的に通過させるという精密な役割を担っています。近年の研究により、この関門の維持にがん抑制遺伝子p53とその制御因子MDM2が関わっていることが明らかになりました。
今回ご紹介するのは、Leveyら(2025年, Science Signaling)による最新の報告で、p53–MDM2軸がnorrin–Frizzled4–βカテニンシグナルを介してBBB/BRB機能を制御するメカニズムが解明されました。さらにこの記事では、この知見をもとに老化や先天的脆弱性、そしてがんの脳転移や中枢播種といった臨床的な視点を加えて考察します。
p53–MDM2軸とは?
p53は「ゲノムの守護者」と呼ばれ、DNA損傷時に細胞周期停止やアポトーシス(細胞死)を誘導することでがん化を防ぐ働きを持ちます。このp53の活性を制御するのがMDM2というタンパク質です。MDM2はp53に結合し、ユビキチン化を介して分解へと導く負のフィードバック制御因子です。
このバランスが崩れると、p53が過剰に活性化して正常組織を傷つけたり、逆に不十分な活性化で腫瘍抑制機能が低下したりします。
norrin–Frizzled4シグナルとバリア機能
BBBやBRBの形成と維持には、norrinというリガンドとFrizzled4受容体を介するシグナルが重要です。この経路は最終的にβカテニン依存的遺伝子発現を活性化し、内皮細胞にバリア特性を付与します。Leveyらの研究では、MDM2を欠損させてp53を高めると、このnorrin–Frizzled4シグナルが低下し、BRBが破綻することが示されました。
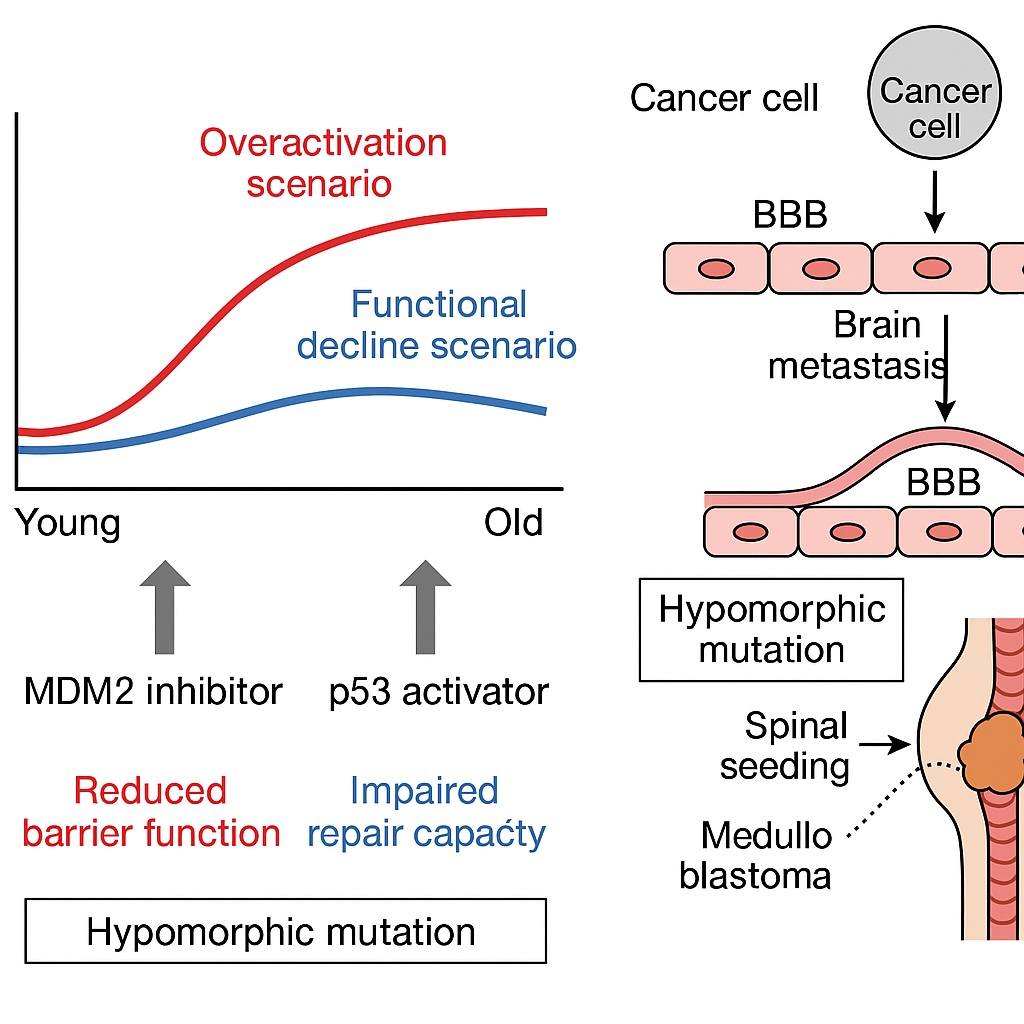
老化がもたらす二つのシナリオ
1. 過剰活性化シナリオ
加齢に伴い、内皮細胞は酸化ストレスやDNA損傷を蓄積します。その結果p53が慢性的に活性化し、内皮細胞の増殖抑制や炎症性サイトカイン(例:CCL2、ICAM-1)産生が持続的に増加します。この状態ではバリア透過性が亢進し、慢性炎症や浮腫が進行します。
2. 機能低下シナリオ
一方で、高齢になるとp53応答そのものが鈍くなり、障害を受けた血管の修復が不十分になるケースもあります。この場合、バリアの損傷が長引き、神経変性疾患や慢性虚血性変化が進行します。
先天的脆弱性(Hypomorphic mutation)
遺伝的にp53–MDM2–norrin経路が弱い人も存在する可能性があります。例えば、NCAPH(染色体凝縮複合体の一部)やnorrin経路構成因子(NDP, FZD4, LRP5, TSPAN12)の低機能型変異は、生涯にわたりバリア機能が弱く、軽度のBBB/BRBリークが持続します。このような人では、糖尿病や加齢による二次的ストレスで症状が顕在化しやすくなります。
がんとBBB/BRB機能
バリア機能は腫瘍の脳転移とも深く関係しています。例えば乳がんや肺がんの脳転移は、腫瘍細胞がBBBを突破する過程が必須です。加齢や先天的脆弱性でBBBが弱まると、この突破が容易になる可能性があります。
興味深いことに、Glioma(膠芽腫など原発性脳腫瘍)は脳内発生であり「脳への転移」という形は取りません。これは腫瘍細胞がすでにBBBの内側に存在しているためで、転移性腫瘍のメカニズムとは異なります。
一方、小児のMedulloblastomaでは脊髄播種(spinal seeding)が知られています。これは髄液を介した転移であり、BBBというより血液–脊髄関門や髄液循環系のバリアとの関係が深い現象です。
MDM2阻害剤・p53活性化剤の臨床的期待とリスク
期待
- 腫瘍細胞や異常血管の増殖抑制
- 脳転移リスク低減(BBB強化による)
- 加齢関連疾患における異常血管新生抑制
リスク
- 過剰p53活性化によるバリア破綻と炎症増悪
- 慢性BBBリークによる神経毒性物質の侵入促進
特に高齢者や遺伝的にバリアが脆弱な患者では、投与設計を慎重に行う必要があります。
臨床応用への道筋
- p53活性度、NCAPH発現、BBB透過性のモニタリング
- norrin経路・NCAPH低機能変異の遺伝スクリーニング
- 抗炎症薬やバリア保護薬との併用戦略
考察:オリジナル視点
今回の知見は、p53–MDM2軸が腫瘍抑制機構だけでなく脳・網膜バリア機能の維持者であることを示しています。加齢や先天的脆弱性がこの軸を弱めると、脳転移や炎症性疾患のリスクが増大する可能性があります。
乳がんなどの固形がんの脳転移、Medulloblastomaの脊髄播種などは、バリア機能障害が腫瘍細胞の浸潤経路を開く一因かもしれません。Gliomaのような原発性腫瘍では関門突破の概念は当てはまりませんが、術後のBBB破綻は再発や二次的浸潤経路を変える可能性があります。
まとめると、バリア機能を守ることはがんの浸潤経路を封じることにもつながるという新しい予防的腫瘍学の視点が得られます。この視点を基に、MDM2阻害剤やp53活性化剤を腫瘍+バリア保護戦略の一環として位置づける研究が期待されます。
もっと読みたい方へ
この記事はMorningglorysciencesの編集チームが制作しました。







コメント