イントロダクション:転写因子とDNA修復の新たな関係
近年のがん研究では、DNAの複製エラーや修復機構の破綻が腫瘍発生の中心的な要因であることが明らかにされてきました。これまでの研究は、DNA複製エラーを修復する「ミスマッチ修復(MMR)」が、がん抑制の重要な防御機構であることを示してきました。一方、転写因子は遺伝子発現を調節する中心的な役割を果たしますが、その結合がDNA修復と衝突する可能性は十分に理解されていませんでした。
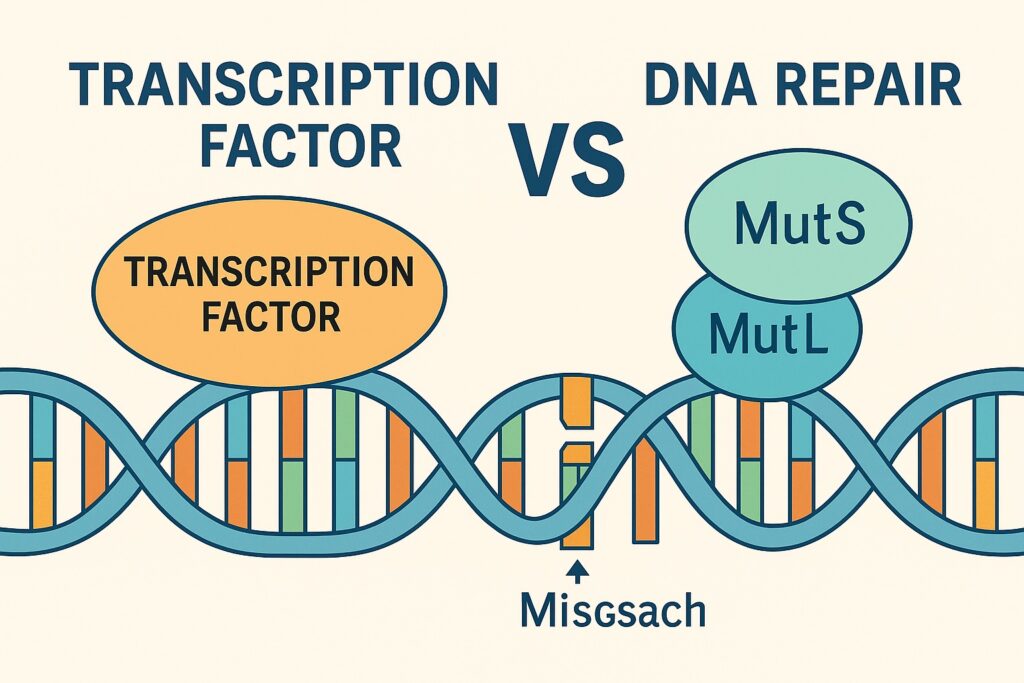
2025年7月にCell誌に掲載された論文「DNA mutagenesis driven by transcription factor competition with mismatch repair」では、転写因子がミスマッチ修復の主要因子MutSαと競合し、その結果としてDNA結合部位に高頻度で突然変異が生じるという新たなメカニズムが報告されました。この発見は、転写活性が単に遺伝子発現を制御するだけでなく、突然変異を誘発し腫瘍進展や悪性化に関与する可能性を示しています。
DNA複製エラーと修復の基礎
DNA複製の高忠実性と限界
真核細胞のDNA複製は極めて高い忠実性を誇り、1回の複製でのエラーは数十億塩基あたり数個に過ぎません。しかし、それでも毎回の細胞分裂でヌクレオチドの誤挿入が発生します。これらのエラーが修復されずに残存すると、遺伝子変異として固定され、がんや遺伝病の原因となります。
ミスマッチ修復(MMR)の役割
ミスマッチ修復は、DNA複製後に残った誤挿入や小さなインデルを認識・修復する機構です。その中心的な役割を担うのがMutSα(MSH2-MSH6複合体)であり、DNAの不一致を検出して修復経路を開始します。この仕組みが失われると、マイクロサテライト不安定性(MSI)が生じ、がんの発生リスクが飛躍的に高まります。
転写因子と修復阻害のこれまでの知見
従来の研究では、転写因子のDNA結合が紫外線損傷やヌクレオチド除去修復を妨害することが報告されていました(Sabarinathanら, Nature 2016)。また、CTCFやcohesinといった転写調節因子が結合する領域はがんにおいて変異が多いことも知られていました(Katainenら, Nat Genet 2015)。これらの結果は、転写因子がDNA修復の「物理的な障害物」となり得ることを示唆していました。
今回のCell論文の新知見
研究の概要
新しいCell論文では、酵母を用いた遺伝学的アッセイにより、転写因子がMutSαと直接競合してDNAミスマッチの認識を阻害し、結果として転写因子結合部位に突然変異が蓄積することが実証されました。この現象は、複数の転写因子ファミリーやMutSαホモログで普遍的に観察されました。
ヒトがんにおける解析
さらにヒトがんゲノムの解析においても、MYCなどの転写因子結合部位における変異率の上昇が確認されました。特にMMRが正常に働く細胞においても、転写因子結合部位での突然変異が濃縮されており、これは修復が転写因子によって阻害されたことを示唆します。
高転写活性と腫瘍進展
MYCは代表的ながん遺伝子であり、細胞成長や代謝を促進する転写因子です。MYCの過剰発現は「転写の増幅」を引き起こし、多数の遺伝子群の転写レベルを押し上げます。今回の研究は、この高転写活性がDNA修復と拮抗し、結果として突然変異を蓄積させることを明らかにしました。すなわち、MYC活性化は腫瘍の「燃料」であると同時に、「変異生成の温床」でもあるのです。
Neoantigen創生と免疫応答
突然変異の一部は新規ペプチド配列(ネオアンチゲン)を生み出し、免疫系に認識されることで腫瘍細胞の標的となります。ミスマッチ修復が不完全であれば、変異の蓄積が加速し、多数のネオアンチゲンが生成されます。この原理はMSI-H腫瘍における免疫チェックポイント阻害薬(ICI)の有効性の根拠となっています。
臨床事例:MSI-H大腸がんとLynch症候群
Memorial Sloan Kettering Cancer Centerで実施された臨床試験(Leら, NEJM 2017)では、Lynch症候群患者を含むMMR欠損型(MSI-H)大腸がんに対してPD-1抗体療法が投与され、驚異的な奏効率が示されました。この試験は、修復異常が生み出す変異=Neoantigenが免疫療法において強力な武器となることを証明しました。
今回のCell論文の知見は、この臨床的成功と直結しています。すなわち、転写因子による修復阻害がNeoantigen生成を増加させ、免疫応答を強化する可能性を秘めているのです。
考察:治療戦略としての新しい視点
今回の研究は、転写因子結合部位での変異ががんにおける二面性を持つことを示しました。一方では腫瘍進展や悪性化を促すリスクであり、他方ではNeoantigen創生を通じて免疫療法の効果を高める「好都合な側面」もあります。今後は、どのがん腫でこの現象が臨床的に活かせるかを解明することが課題となるでしょう。
特に大腸がん(MSI-H)やLynch症候群は典型例ですが、MYC活性化が顕著な腫瘍や他の高転写活性腫瘍でも、同様の免疫療法感受性が期待されます。
まとめと展望
転写因子とDNA修復の競合は、これまで見過ごされてきた突然変異生成の新たな起点です。この現象は、がん悪性化の理解を深めると同時に、Neoantigenを利用した免疫療法の新しい可能性を開きます。今後、がん研究と治療戦略は「転写活性」と「DNA修復」のせめぎ合いに注目することになるでしょう。
参考文献
- Wei Zhu et al. Cell, 2025. “DNA mutagenesis driven by transcription factor competition with mismatch repair”
- Sabarinathan R. et al. Nature, 2016. “Nucleotide excision repair is impaired by binding of transcription factors to DNA”
- Katainen R. et al. Nature Genetics, 2015. “CTCF/cohesin-binding sites are frequently mutated in cancer”
- Le DT. et al. New England Journal of Medicine, 2017. “Mismatch repair deficiency predicts response of solid tumors to PD-1 blockade”
- Gabay M. et al. Cold Spring Harb Perspect Med, 2014. “MYC activation is a hallmark of cancer initiation and maintenance”
この記事はMorningglorysciencesチームによって編集されました。









コメント